Механизм мышечного сокращения
11.06.2014
Механизм мышечного сокращения
Что такое мышечное сокращение - изменение размера мышечной клетки под действием нервного импульса. Это одна из самых жизненно важных функций живого организма, связанная с дыханием, сердцебиением и кровотоком, пищеварением и другими жизненно важными процессами.
Все произвольные виды движения, а именно: ходьба, глотание, моргание. Непроизвольные движения, это те, что не контролируются сознательно, а именно: желудочная перистальтика, сокращение желчного и мочевого пузыря, изменение тонуса кровеносных сосудов. Первый вид сокращения проходит под действием сокращения поперечно-полосатой мускулатуры, второй вид – гладкая мускулатура. Сердечная мышца тоже сокращается непроизвольно, но она состоит из сердечной мышечной ткани, которая не является гладкой мускулатурой.
В основе сокращения мышечных волокон служит актино-миозиновое взаимодействие. За само мышечное сокращение отвечают мышечные волокна, а именно: миофибриллы, из которых на 2/3 состоят сухие мышечные ткани. Миофибриллы, толщиной 1-2 мкм, состоящие из саркомеров с длинной около 3 мкм, которые состоят из миозиновых и актиновых (толстых и тонких) волокон и Z дисков, которые соединены с актиновыми филаментами. Само сокращение происходит, когда увеличивается в цитоплазме клеток концентрация Cа, при этом происходит скольжение миозиновых волокон, относительно актиновых. Главным источником энергии является АТФ.
Головка миозинового волокна использует АТФ энергию, в следствии чего, изменяется конформация, и происходит скольжение по актиновому волокну. Сам цикл можно условно разделить на 4 этапа, а именно:
- Головка миозинового волокна связывается с АТФ, происходит процесс отщепления фосфорной группы, и образуется дифосфатное соединение – АДФ. Сама головка остается связана с АДФ и фосфат группой;
- Миозиновая головка начинает связываться со следующей субъединицей актина, фосфат группа отдаляется, возникает прочная миозино-актиновая связь, и этот процесс является не обратимый;
- Головка миозина начинает конформационное изменение, происходит подтягивание толстого волокна к Z-диску;
- Начинает отделяться и АДФ, в следствии головка отделяется от актинового волокна, присоединяется новая молекула АТФ.
Дальше сам цикл продолжается до уменьшения концентрации ионов кальция, или до полного исчерпания АТФ энергии. Сама скорость движения миозина относительно актина около 15 мкм на секунду. В самом миозиновом филаменте, больше 500 молекул миозина, в следствии чего, происходит очень сильное и быстрое сокращение волокон. Нужно отметить, что миозин это актин-АТФ зависимый, так как каждый цикл зависит от гидролизации АТФ, и от актинового взаимодействия.
Для сокращения мышечного волокна используется энергия, которая получена в следствии гидролизации АТФ, но клетка мышц имеет очень эффективную систему регенерации АТФ, так что в расслабленной так и работающей мышце количество АТФ одинаково.
Существует фермент фосфокреатинкиназа, который катализирует реакцию между креатинфосфатом и АДФ, продукт – креатин и АТФ. Количество запасённой энергии больше в креатинфосфате чем в АТФ. При быстрому увеличении активности в мышечной клетке, падает резко содержание креатинфосфата, а количество АТФ не меняется.
Механизм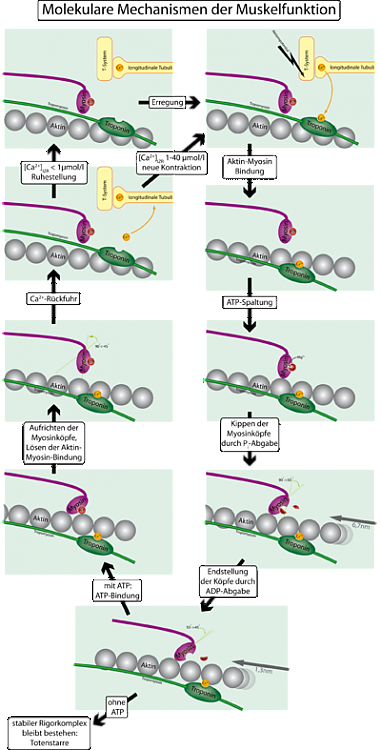
Нейроны есть основными регуляторами мышечной активности, но есть исключения, когда например, гладкой мышечной мускулатурой управляют гормоны, такие как окситоцин, адреналин, норадреналин.
Сигнал на сокращение можно разделить на такие этапы:
Медиатор, который выделился с мотонейрона, вызывает потенциал действия на мембрану клетки мышц, который проходит дальше, благодаря мембранным выпячиваниям ( так называемые Т-трубочки), которые находятся радиально направленны внутрь клетки. Дальше сигнал от Т-трубочек, передается на эндоплазматическую сеть (органела клетки состоящей из мембранных пузырьков). Данный сигнал приводит к открытию кальциевых каналов, в эндоплазматической мембране. Обратно заходит кальций, благодаря кальций-АТФ активным насосам.
Для контроля сокращения, к активному волокну прикрепляется комплекс из трёх белков – тропонин (из субъединиц І, Т, С), и белка – тропомиозин. Через каждые семь актиновых субъединиц, находится комплекс тропонина. Связь тропонина І с актином, перемещает белок тропомиозин в положение, которое мешает актино-миозиновому соединению. Субъеденица тропонина С связывается с четырьмя ионами кальция, вследствии чего ослабевает действие тропонина I на актиновое волокно, а тропомиозин переходит в положение не мешающий связи миозина с актином. Самым главным источником для сокращения мышечного волокна – АТФ.
Активизируется каталитический центр, так как происходит инактивация тропонина ионами кальция, для расщепления молекулы АТФ на головке миозина. Гидролизуется АТФ ферментом миозин АТФ-фазой, которая находится на головке миозинового волокна, которая и обеспечивает энергией поперечные мостики. Полученный АДФ и неорганический фосфат, с молекулы АТФ, используется для ресинтеза новой молекулы АТФ. На миозиновом мостике синтезируется новая молекула АТФ, при этом происходит отсоединение актина с поперечным мостиком. Повторное отсоединение и прикрепление мостиков происходит до того момента, пока концентрация Са внутри волокна не уменьшится до подпорогового уровня. Тогда уже мышечные волокна начнут расслабляться.









Комментарии
Пока нет комментариев